常温下,一元酸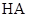 的
的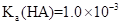 。在某体系中,
。在某体系中,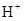 与
与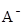 离子不能穿过隔膜,未电离的
离子不能穿过隔膜,未电离的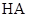 可自由穿过该膜(如图所示)。
可自由穿过该膜(如图所示)。
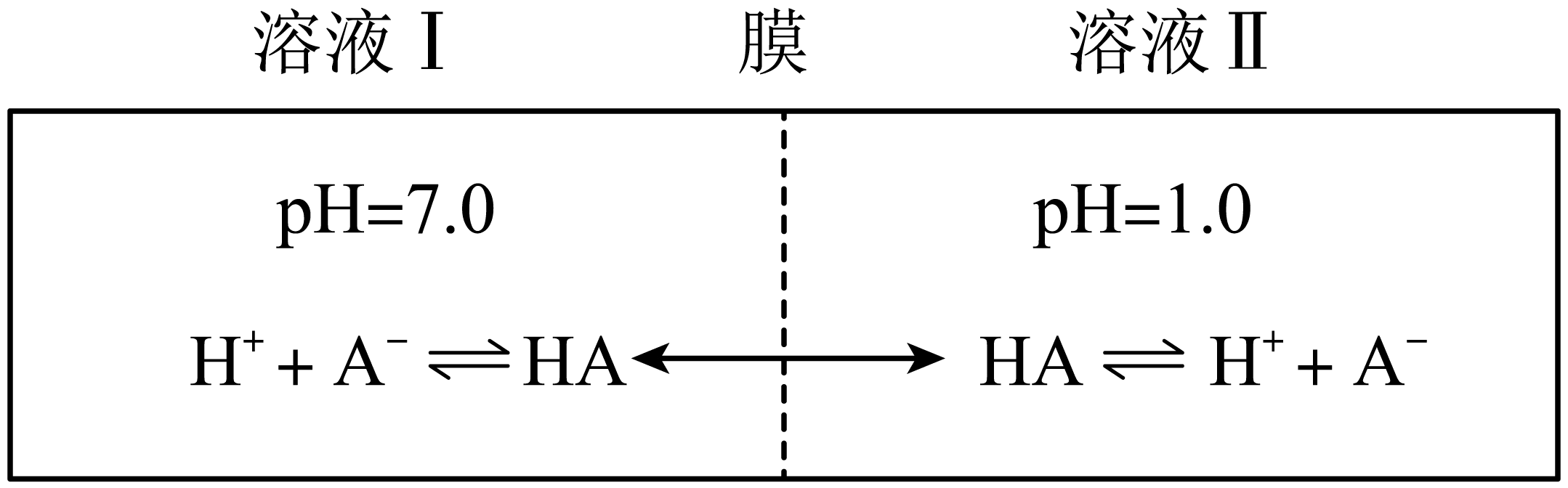
设溶液中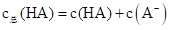 ,当达到平衡时,下列叙述正确的是
,当达到平衡时,下列叙述正确的是
A
溶液Ⅰ中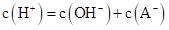
B
溶液Ⅱ中的HA的电离度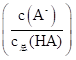 为
为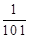
C
溶液Ⅰ和Ⅱ中的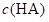 不相等
不相等
D
溶液Ⅰ和Ⅱ中的 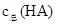 之比为
之比为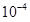
答案
B
解析
【详解】A.常温下溶液I的pH=7.0,则溶液I中c(H+)=c(OH-)=1×10-7mol/L,c(H+)<c(OH-)+c(A-),A错误;
B.常温下溶液II的pH=1.0,溶液中c(H+)=0.1mol/L,Ka=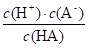 =1.0×10-3,c总(HA)=c(HA)+c(A-),则
=1.0×10-3,c总(HA)=c(HA)+c(A-),则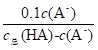 =1.0×10-3,解得
=1.0×10-3,解得 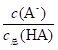 =
=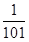 ,B正确;
,B正确;
C.根据题意,未电离的HA可自由穿过隔膜,故溶液I和II中的c(HA)相等,C错误;
D.常温下溶液I的pH=7.0,溶液I中c(H+)=1×10-7mol/L,Ka=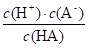 =1.0×10-3,c总(HA)=c(HA)+c(A-),
=1.0×10-3,c总(HA)=c(HA)+c(A-), 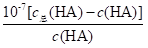 =1.0×10-3,溶液I中c总(HA)=(104+1)c(HA),溶液II的pH=1.0,溶液II中c(H+)=0.1mol/L,Ka=
=1.0×10-3,溶液I中c总(HA)=(104+1)c(HA),溶液II的pH=1.0,溶液II中c(H+)=0.1mol/L,Ka=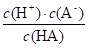 =1.0×10-3,c总(HA)=c(HA)+c(A-),
=1.0×10-3,c总(HA)=c(HA)+c(A-), 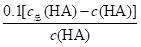 =1.0×10-3,溶液II中c总(HA)=1.01c(HA),未电离的HA可自由穿过隔膜,故溶液I和II中的c(HA)相等,溶液I和II中c总(HA)之比为[(104+1)c(HA)]:[1.01c(HA)]=(104+1):1.01≈104,D错误;
=1.0×10-3,溶液II中c总(HA)=1.01c(HA),未电离的HA可自由穿过隔膜,故溶液I和II中的c(HA)相等,溶液I和II中c总(HA)之比为[(104+1)c(HA)]:[1.01c(HA)]=(104+1):1.01≈104,D错误;
答案选B



